Reines Eisen (Fe) hat einen normalen Schmelzpunkt von 1538 °C (1811 K / 2800 °F) bei einer Atmosphäre; dies ist die Temperatur, bei der δ-Ferrit (kubisch-raumzentriertes Hochtemperatureisen) flüssig wird. Dieser Wert ist die akzeptierte Referenz in metallurgischen Handbüchern und thermochemischen Datenbanken.
Was der Schmelzpunkt für ein Metall bedeutet
Wenn Metallurgen von "Schmelzpunkt" für ein reines Metall sprechen, meinen sie normalerweise den Gleichgewichtstemperatur, bei der der kristalline Feststoff und die Flüssigkeit bei 1 Atmosphäre koexistieren - streng genommen der normale Schmelzpunkt (oder der normale Gefrierpunkt). Für technische Legierungen - einschließlich Stähle und Gusseisen - gibt es normalerweise einen Schmelzbereich zwischen einer solidus (erste Flüssigkeit erscheint beim Erhitzen) und eine liquidus (letzter Feststoff löst sich in Flüssigkeit auf). Numerische Schmelzzahlen für Metalle behandeln als Referenzwerte die für sehr reine Gleichgewichtsbedingungen gelten; reale Materialien verhalten sich in der Regel anders.
Reines Eisen: numerische Werte und maßgebliche Datensätze
Der allgemein akzeptierte normale Schmelzpunkt von elementarem Eisen ist 1538 °C (1811 K / 2800 °F) bei Standardatmosphärendruck. Dieser Wert wird von nationalen und internationalen Datenquellen angegeben, die von Ingenieuren und Wissenschaftlern verwendet werden (NIST, CRC, ASM, PDG/LBL, wichtige Chemiehandbücher). Der normale Siedepunkt von Eisen bei 1 atm liegt bei etwa 2860-2862 °C (≈3134 K)Verschiedene Referenzen runden je nach Mess- und Bewertungsmethode leicht unterschiedlich ab.
Belastbare numerische Fakten:
-
Normaler Schmelzpunkt (reines Fe): 1538 °C (1811 K / 2800 °F).
-
Typische Literaturverteilung: ≈1535-1539 °C je nach Versuchsmethode und Reinheit.
-
Latente Wärme (Schmelzen) in der Nähe des Schmelzpunkts: ≈247 kJ/kg (gemeldeter empfohlener Durchschnitt).
Eisenallotrope und Phasenübergänge, die zum Schmelzen führen
Eisen weist je nach Temperatur mehrere kristalline Formen (Allotrope) auf:
| Allotrop | Symbol | Kristallstruktur | Stabiler Temperaturbereich (ca., 1 atm) |
|---|---|---|---|
| Alpha-Eisen | α-Fe | BCC (Ferrit) | bis zu 912 °C |
| Gamma-Eisen | γ-Fe | FCC (Austenit) | 912 °C → 1394 °C |
| Delta-Eisen | δ-Fe | BCC (Hoch-T-Ferrit) | 1394 °C → 1538 °C (Schmelzen) |
| Flüssig | L | - | > 1538 °C (für reines Fe) |
Die Übergänge fest → fest (α↔γ um 912 °C und γ↔δ um 1394 °C) sind kritisch, da die δ-Phase diejenige ist, die bei der Referenztemperatur von 1538 °C schmilzt. Diese Übergangstemperaturen sind in Phasendiagrammen und Handbüchern gut dokumentiert.
Warum die einheitliche Zahl (1538 °C) nützlich ist - und wann sie es nicht ist
Diese einzige Zahl ist für Vergleiche und grundlegende Berechnungen (Thermodynamik, Sollwerte für Öfen und historisch gesehen für den Unterricht) äußerst hilfreich. Die unkritische Verwendung von 1538 °C kann jedoch in die Irre führen:
-
Legierungen: Die Zugabe von Kohlenstoff, Silizium, Nickel, Chrom oder anderen Elementen verschiebt den Solidus/Liquidus weit.
-
Verunreinigungen: Schwefel-, Phosphor-, Sauerstoff- und Schlackenphasen erzeugen eutektische Punkte unterhalb der Schmelztemperatur von reinem Eisen.
-
Nicht-Gleichgewichts-Erwärmung: Schnelles Erhitzen, Überhitzung oder Unterkühlung verursachen ein vorübergehendes Verhalten, das vom Gleichgewichtsschmelzen abweicht.
-
Druck: Hoher Druck verschiebt die Schmelztemperatur (relevant für Geophysik und Hochdruckexperimente).
Daher sollten Ingenieure, die mit Stahl, Gusseisen oder speziellen Legierungen arbeiten, Phasendiagramme und Herstellerangaben für Solidus-/Liquidus-Werte heranziehen und nicht nur die reine Fe-Zahl.
Wie Kohlenstoff die Schmelztemperatur von Eisen beeinflusst
Kohlenstoff senkt den Schmelzpunkt von Eisen, wenn er Lösungen oder Karbide bildet. Das Eisen-Kohlenstoff-System (Fe-C) ist die Grundlage der Stahlmetallurgie; es folgen einige praktische Bereiche:
| Material | Typischer Kohlenstoff (wt%) | Typisches Solidus/Liquidus/Schmelzverhalten (ca.) |
|---|---|---|
| Reines Eisen | 0.00 | 1538 °C (Einzelwert) |
| Stahl mit niedrigem Kohlenstoffgehalt | 0.05-0.25 | Solidus ≈ 1450-1500 °C, Liquidus ≈ 1500-1540 °C (variiert) |
| Stahl mit mittlerem Kohlenstoffgehalt | 0.25-0.60 | Solidus ≈ 1420-1490 °C, Liquidus ≈ 1480-1530 °C |
| Stahl mit hohem Kohlenstoffgehalt / Werkzeugstähle | 0.6-2.0 | Solidus kann weiter sinken; eutektische Eigenschaften bei Vorhandensein anderer Legierungselemente |
| Gusseisen (weiß/grau) | 2.0-4.0 | Komplexes Schmelzen mit Eutektika; Liquidus oft 1150-1250 °C (abhängig von Graphit und Karbid) |
Hinweis: Die Liquidus-/Feststoffwerte von Gusseisen variieren stark je nach Zusammensetzung und Gießereipraxis - viele Gusseisen schmelzen aufgrund von Eutektika und Graphitbildung bei wesentlich niedrigeren Ofentemperaturen als reines Eisen. Die Phasendiagramme von Gusseisen und Fe-C liefern detaillierte Grenzen.
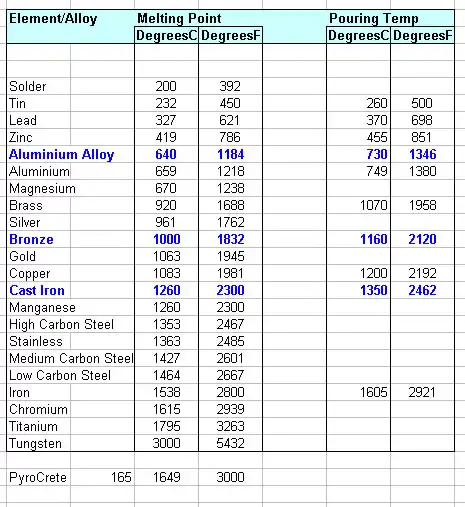
Schneller Vergleich: Schmelzpunkte der gängigen Metalle (Referenztabelle)
| Element/Material | Schmelzpunkt (°C) | Schmelzpunkt (°F) |
|---|---|---|
| Eisen (Fe, rein) | 1538 | 2800 |
| Kupfer (Cu) | 1084 | 1983 |
| Aluminium (Al) | 660.3 | 1220 |
| Nickel (Ni) | 1455 | 2651 |
| Chrom (Cr) | 1907 | 3465 |
| Titan (Ti) | 1668 | 3034 |
| (Daten aus Standardhandbüchern für das Ingenieurwesen). |
Messmethoden und praktische Überlegungen
Die Messung der Schmelztemperatur eines Metalls erfordert eine sorgfältige Technik. Zu den gängigen Methoden gehören:
-
Differential-Scanning-Kalorimetrie (DSC) / Differential-Thermoanalyse (DTA): Misst den Wärmefluss und erkennt endotherme Schmelzspitzen; hervorragend geeignet für kleine Proben und Legierungen.
-
Optische Hochtemperatur-Pyrometrie mit Tiegelmethode: Bei hochschmelzenden Metallen kann das Schmelzen visuell oder durch emissivitätskorrigierte Pyrometrie nachgewiesen werden.
-
Elektrostatisches Schweben + Lasererwärmung: Wird in der Spezialforschung verwendet, um Verunreinigungen und Tiegelreaktionen zu vermeiden; nützlich für Studien mit überhitzten Flüssigkeiten und unterkühltem Gefrieren.
-
Statische/analytische Methoden: Fall- oder Tauchtechniken, die in der Vergangenheit in Metallurgielabors verwendet wurden.
Bei jeder Methode gibt es Unsicherheitsquellen: Reinheit der Probe, Wechselwirkungen zwischen Tiegel und Probe, Atmosphäre (Sauerstoff kann oxidieren und das scheinbare Schmelzverhalten verändern), Heizrate und Kalibrierung. Für genaue Daten konsultieren Sie primäre Standardlaboratorien (NIST, nationale Metrologieinstitute).
Thermophysikalische Eigenschaften um den Schmelzpunkt
Wichtige thermophysikalische Eigenschaften, die in der Nähe des Schmelzpunkts von Bedeutung sind (ungefähre Werte für reines Fe):
-
Latente Schmelzwärme: ≈ 247 kJ/kg (Energie, die erforderlich ist, um 1 kg am Schmelzpunkt zu schmelzen).
-
Veränderung der Dichte: Bei Metallen nimmt die Dichte beim Schmelzen in der Regel ab; bei Eisen ist diese Änderung material- und phasenabhängig.
-
Wärmekapazität: Cp steigt mit der Temperatur; für die Schätzung der Ofenenergie ist ein genaues Verhältnis von Cp zu T erforderlich (NIST und Handbücher liefern angepasste Shomate- oder Polynomkoeffizienten).
Ingenieure nutzen diese Eigenschaften, um Öfen zu dimensionieren, den Energieverbrauch beim Schmelzen zu berechnen und die Erstarrung in Gießsimulationen zu modellieren.
Industrielle Auswirkungen - Schmelzen, Gießen, Schweißen und Wärmebehandlung
Das Schmelzverhalten von Eisen hat praktische Auswirkungen:
-
Gießerei-Praxis: Die Gießereien stellen die Ofen- und Pfannentemperaturen so ein, dass sie den Liquidus der jeweiligen Legierung übersteigen; für viele Stähle bedeutet dies, dass sie ~1550-1600 °C in einem Lichtbogen- oder Induktionsofen für die richtige Überhitzung und den Pfannentransfer. Gusseisen schmilzt in vielen Fällen bei niedrigeren Temperaturen.
-
Schweißen: Lokales Schmelzen beim Schweißen muss kontrolliert werden, um übermäßige Verdünnung, Durchbrennen oder Versprödung durch Legierungselemente zu vermeiden.
-
Wärmebehandlung: Obwohl Wärmebehandlungen selten an das Schmelzen heranreichen, treten die kritischen Umwandlungstemperaturen (z. B. A1, A3), die das Mikrogefüge bestimmen, weit unterhalb des Schmelzpunkts auf, so dass genaue Phasendiagramme und TTT/CCT-Daten verwendet werden.
-
Additive Fertigung (Metall-AM): Schmelz- und Erstarrungsgeschwindigkeit sind für die Mikrostruktur von großer Bedeutung - die Druckparameter werden auf die Schmelzeigenschaften abgestimmt.
Gute Praxis: Arbeiten Sie immer von der des Materials dokumentierte Solidus/Flüssigkeit und die von der Gießerei oder dem Werk empfohlenen Ofentemperaturen, nicht nur die Schmelzzahl des reinen Fe.
Druck und extreme Bedingungen
Bei Umgebungsdruck gilt die Referenztemperatur von 1538 °C. Unter hohem Druck verschiebt sich das Schmelzverhalten (wichtig für die Geophysik und die Hochdruckmaterialforschung). Experimentelle und berechnete Phasendiagramme bei GPa-Druck zeigen, dass die Schmelztemperatur von Fe mit dem Druck ansteigen kann; solche Verschiebungen liegen außerhalb der normalen industriellen Relevanz, sind aber für die Modellierung von Erdkernen und Hochdruckgeräten von entscheidender Bedeutung. Fachpublikationen und NIST/PDG-Zusammenfassungen dokumentieren druckabhängige Schmelzlinien.
Häufige Fehler und wie man sie vermeidet
-
Verwendung der reinen Fe-Zahl für Legierungen: führt zu falschen Einstellungen des Ofens. Verwenden Sie immer materialspezifische Daten.
-
Verwechslung von Schmelzpunkt und Solidus/Liquidus: bei Legierungen handelt es sich um Bereiche, nicht um Einzelwerte.
-
Ignorieren von Atmosphäre und Kontamination: Oxidation oder Tiegelreaktionen verändern das Schmelzverhalten. Bei Bedarf Inertgas oder Vakuum verwenden.
-
Verwendung von nicht kalibrierten Thermoelementen oder Pyrometern: Eine auf Standards rückführbare Kalibrierung ist für genaue Temperaturen unerlässlich.
Praktische Tabellen für Ingenieure
Repräsentative Solidus-/Liquidus-Bereiche (Technik ca.)
| Familie der Materialien | Beispiel für die Zusammensetzung | Ungefährer Solidus (°C) | Ungefährer Liquidus (°C) | Anmerkungen |
|---|---|---|---|---|
| Reines Eisen | 0% C | 1538 (einfach) | 1538 | Referenz reines Fe |
| Stahl mit niedrigem Kohlenstoffgehalt | 0,05-0,25% C | 1450-1500 | 1500-1540 | Abhängig von der Legierung |
| Rostfreier Stahl (austenitisch) | Fe-18Cr-8Ni | ~1390-1450 | ~1450-1520 | Ni/Cr erhöhen oder senken das lokale Schmelzverhalten |
| Graues Gusseisen | 2-4% C (Graphit) | ~1150 | ~1200-1250 | Eutektische Eigenschaften mit Graphit |
FAQs
-
Q: Wie hoch ist der Schmelzpunkt von Eisen?
A: 1538 °C (1811 K / 2800 °F) für elementares Eisen bei 1 atm. -
Q: Schmelzt Stahl bei der gleichen Temperatur wie reines Eisen?
A: Nein. Stahl ist eine Legierung und weist einen Schmelzpunkt auf. Bereich (Solidus zu Liquidus), die vom Kohlenstoff- und Legierungsgehalt abhängt; viele Stähle schmelzen etwas unterhalb oder in der Nähe der Rein-Fe-Zahl. -
Q: Warum verwenden Gießereien Ofentemperaturen über 1538 °C?
A: Öfen warten Überhitzung über dem Liquidus, um eine gute Fließfähigkeit zu gewährleisten, Zeit für die Entgasung zu haben und die Wärmeverluste während der Übertragung auszugleichen. Typische Stahlerhitzungen werden je nach Legierung und Verfahren oft bei ~1550-1600 °C gehalten. -
Q: Wie beeinflusst die Kohlenstoffkonzentration das Schmelzen?
A: Kohlenstoff senkt den Schmelzpunkt durch eutektische Reaktionen; Gusseisen (mit hohem C-Gehalt) hat in der Regel eine viel niedrigere Liquidustemperatur als reines Eisen. Siehe Fe-C-Phasendiagramme. -
Q: Können Verunreinigungen den Schmelzpunkt erhöhen?
A: Einige Elemente erhöhen und einige senken den Liquidus; so erhöhen Chrom und Wolfram in der Regel die Hochtemperaturfestigkeit und können das Schmelzverhalten in bestimmten Legierungen erhöhen, während Kohlenstoff und Schwefel einige Schmelzgrenzen senken. Die genauen Auswirkungen hängen von der Zusammensetzung ab. -
Q: Wie genau ist 1538 °C?
A: Verschiedene maßgebliche Quellen weichen leicht voneinander ab; die experimentellen Werte können je nach Reinheit und Messmethode um einige °C variieren. Die typische gemeldete Spanne beträgt ~1535-1539 °C. -
Q: Wie hoch ist die latente Schmelzwärme von Eisen?
A: Ungefähr 247 kJ/kgdie für die Energieplanung beim Schmelzen verwendet wird. -
Q: Verändert der Luftsauerstoff das effektive Schmelzverhalten?
A: Ja, Oxidation, die Bildung von Schlacken- und Oxidschichten sowie Tiegelreaktionen können das scheinbare Schmelzverhalten verändern und müssen durch Flussmittel, Schlackenmanagement oder inerte Atmosphären kontrolliert werden. -
Q: Gibt es Standardreferenzen für Schmelzpunkte?
A: Ja! Das NIST WebBook, das CRC Handbook, die ASM-Handbücher und die PDG/LBL-Tabellen werden häufig für zuverlässige thermophysikalische Daten verwendet. -
Q: Wo kann ich den Solidus/Liquidus für eine bestimmte industrielle Stahlsorte finden?
A: Konsultieren Sie das Datenblatt des Stahlherstellers, Standardreferenzen (z. B. ASM, veröffentlichte Fe-C- und Mehrkomponenten-Phasendiagramme) oder thermodynamische Datenbanken (z. B. Thermo-Calc, FactSage), um genaue Daten über die Phasengrenze zu erhalten.
Abschließende Hinweise für Praktiker
-
Verwenden Sie die 1538 °C nur als Basiswert für reines Eisen angegeben.
-
Verlassen Sie sich bei der Prozesskontrolle stets auf materialspezifische Solidus-/Flüssigkeitswerte, Datenblätter von Mühlen und Gießereien sowie kalibrierte Messgeräte.
-
Bei Veröffentlichungen oder Konstruktionsarbeiten sind maßgebliche Datenbanken (NIST/CRC/ASM) zu nennen und die Bedingungen (Druck, Atmosphäre, Zusammensetzung) anzugeben, unter denen die Temperaturen gelten.
Maßgebliche Referenzen
- NIST Chemistry WebBook - Thermochemische Daten und Daten zur kondensierten Phase von Eisen (Fe)
- PubChem / NCBI - Zusammenfassung und physikalische Daten von Eisen (Element) (einschließlich CRC-Referenzen)
- Particle Data Group / LBL - Fe (Eisen) Atom- und Phasendaten (Schmelz-/Siedetemperaturen)
- ASM International - Metallhandbücher und Kapitel über die Eigenschaften reiner Metalle (erfordert Zugang)
- Ressourcen für Fe-C-Phasendiagramme und Erklärungsmaterial (akademische Zusammenfassungen/Handbücher)

