El hierro puro (Fe) tiene un punto de fusión normal de 1538 °C (1811 K / 2800 °F) a una atmósfera; ésta es la temperatura a la que la δ-ferrita (hierro cúbico centrado en el cuerpo a alta temperatura) se vuelve líquida. Este valor es la referencia aceptada en los manuales de metalurgia y las bases de datos termoquímicas.
Qué significa el punto de fusión de un metal
Cuando los metalúrgicos dicen "punto de fusión" de un metal puro, normalmente se refieren al temperatura de equilibrio a la que coexisten el sólido cristalino y el líquido a 1 atmósfera - estrictamente el punto de fusión normal (o punto de congelación normal). En el caso de las aleaciones de ingeniería -incluidos los aceros y los hierros fundidos- suele haber un intervalo de fusión entre un solidus (aparece el primer líquido al calentarse) y un liquidus (el último sólido se disuelve en líquido). Tratar los números de fusión numéricos de los metales como valores de referencia que se aplican a condiciones de equilibrio muy puras; los materiales del mundo real suelen comportarse de forma diferente.
Hierro puro: valores numéricos y conjuntos de datos fidedignos
El punto de fusión normal comúnmente aceptado del hierro elemental es 1538 °C (1811 K / 2800 °F) a presión atmosférica estándar. Este valor figura en fuentes de datos nacionales e internacionales utilizadas por ingenieros y científicos (NIST, CRC, ASM, PDG/LBL, principales manuales de química). El punto de ebullición normal del hierro a 1 atm es de aproximadamente 2860-2862 °C (≈3134 K); las distintas referencias redondean de forma ligeramente diferente en función del método de medición y evaluación.
Hechos numéricos portantes:
-
Punto de fusión normal (Fe puro): 1538 °C (1811 K / 2800 °F).
-
Propagación típica de literatura: ≈1535-1539 °C en función del método experimental y de la pureza.
-
Calor latente (fusión) cerca del punto de fusión: ≈247 kJ/kg (media recomendada comunicada).
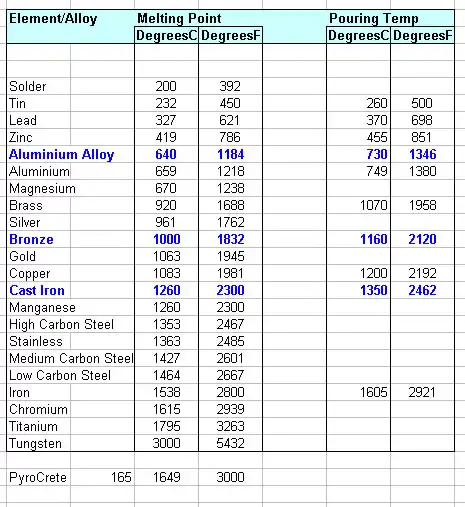
Alótropos del hierro y transiciones de fase que conducen a la fusión
El hierro presenta múltiples formas cristalinas (alótropos) con la temperatura:
| Alótropo | Símbolo | Estructura cristalina | Rango de temperatura estable (aprox., 1 atm) |
|---|---|---|---|
| Hierro alfa | α-Fe | BCC (ferrita) | hasta 912 °C |
| Hierro gamma | γ-Fe | FCC (austenita) | 912 °C → 1394 °C |
| Hierro delta | δ-Fe | BCC (ferrita de alta temperatura) | 1394 °C → 1538 °C (fusión) |
| Líquido | L | - | > 1538 °C (para Fe puro) |
Las transiciones sólido → sólido (α↔γ alrededor de 912 °C y γ↔δ alrededor de 1394 °C) son críticas porque la fase δ es la que funde en la referencia de 1538 °C. Estas temperaturas de transición están bien documentadas en diagramas de fases y manuales.
Por qué es útil el número único (1538 °C) y cuándo no lo es
Este número único es muy útil para comparar y realizar cálculos básicos (termodinámica, puntos de ajuste de hornos e históricamente en la enseñanza). Sin embargo, utilizar acríticamente 1538 °C puede inducir a error:
-
Aleaciones: La adición de carbono, silicio, níquel, cromo u otros elementos desplaza ampliamente el solidus/liquidus.
-
Impurezas: Las fases de azufre, fósforo, oxígeno y escoria producen puntos eutécticos por debajo de la temperatura de fusión del Fe puro.
-
Calentamiento no equilibrado: El calentamiento rápido, el recalentamiento o el subenfriamiento provocan un comportamiento transitorio que se aleja de la fusión de equilibrio.
-
Presión: La alta presión desplaza la temperatura de fusión (relevante para la geofísica y los experimentos de alta presión).
Por lo tanto, los ingenieros que trabajen con acero, hierro fundido o aleaciones especializadas deben consultar los diagramas de fases y los datos del fabricante para conocer los valores de solidus/liquidus en lugar del número único de Fe puro.
Cómo afecta el carbono a la temperatura de fusión del hierro
El carbono reduce el punto de fusión del hierro cuando forma soluciones o carburos. El sistema hierro-carbono (Fe-C) es la base de la metalurgia del acero; a continuación se exponen algunas gamas prácticas:
| Material | Carbono típico (wt%) | Comportamiento típico de solidus/liquidus / fusión (aprox.) |
|---|---|---|
| Hierro puro | 0.00 | 1538 °C (valor único) |
| Acero bajo en carbono | 0.05-0.25 | Solidus ≈ 1450-1500 °C, Liquidus ≈ 1500-1540 °C (varía) |
| Acero medio carbono | 0.25-0.60 | Solidus ≈ 1420-1490 °C, Liquidus ≈ 1480-1530 °C |
| Aceros con alto contenido en carbono / aceros para herramientas | 0.6-2.0 | El solidus puede descender más; características eutécticas si hay otras aleaciones presentes. |
| Hierro fundido (blanco/gris) | 2.0-4.0 | Fusión compleja con eutécticos; liquidus a menudo 1150-1250 °C (grafito, carburo dependiente) |
Nota: los valores liquidus/solidus de la fundición varían mucho en función de la composición y de la práctica de la fundición - muchas fundiciones se funden a temperaturas de horno sustancialmente inferiores a las del hierro puro debido a las eutécticas y a la formación de grafito. Los diagramas de fases de los fractales y del Fe-C proporcionan límites detallados.
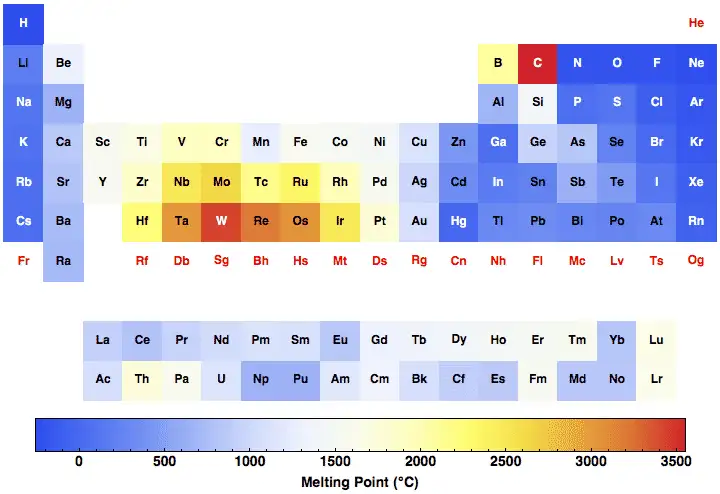
Comparación rápida: puntos de fusión de metales comunes (tabla de referencia)
| Elemento / material | Punto de fusión (°C) | Punto de fusión (°F) |
|---|---|---|
| Hierro (Fe, puro) | 1538 | 2800 |
| Cobre (Cu) | 1084 | 1983 |
| Aluminio (Al) | 660.3 | 1220 |
| Níquel (Ni) | 1455 | 2651 |
| Cromo (Cr) | 1907 | 3465 |
| Titanio (Ti) | 1668 | 3034 |
| (Datos de manuales estándar utilizados en ingeniería). |
Métodos de medición y consideraciones prácticas
Medir la temperatura de fusión de un metal requiere una técnica cuidadosa. Los métodos más comunes son:
-
Calorimetría diferencial de barrido (DSC) / Análisis térmico diferencial (DTA): Mide el flujo de calor y detecta los picos de fusión endotérmica; excelente para muestras pequeñas y aleaciones.
-
Pirometría óptica de alta temperatura con método de crisol: En el caso de los metales refractarios, la fusión puede detectarse visualmente o mediante pirometría con corrección de emisividad.
-
Levitación electrostática + calentamiento por láser: Se utiliza en investigaciones especializadas para evitar la contaminación y las reacciones en el crisol; útil para líquidos sobrecalentados y estudios de congelación subenfriada.
-
Métodos estáticos/analíticos: Técnicas de gota o inmersión utilizadas históricamente en los laboratorios de metalurgia.
Cada método tiene fuentes de incertidumbre: pureza de la muestra, interacciones crisol-muestra, atmósfera (el oxígeno puede oxidar y cambiar el comportamiento aparente de la fusión), velocidad de calentamiento y calibración. Para obtener datos rigurosos, consulte los laboratorios de patrones primarios (NIST, institutos nacionales de metrología).
Propiedades termofísicas en torno a la fusión
Propiedades termofísicas importantes que importan cerca del punto de fusión (valores aproximados para el Fe puro):
-
Calor latente de fusión: ≈ 247 kJ/kg (energía necesaria para fundir 1 kg en el punto de fusión).
-
Cambio de densidad: Los metales suelen disminuir su densidad al fundirse; en el caso del hierro, el cambio depende del material y de la fase.
-
Capacidad calorífica: El Cp aumenta con la temperatura; se requiere un Cp vs T preciso para estimar la energía del horno (el NIST y los manuales proporcionan coeficientes Shomate o polinomiales ajustados).
Los ingenieros utilizan estas propiedades para dimensionar hornos, calcular el consumo energético de la fundición y modelizar la solidificación en simulaciones de colada.
Implicaciones industriales - fundición, moldeado, soldadura y tratamiento térmico
Entre las repercusiones prácticas del comportamiento de fusión del hierro se incluyen:
-
Práctica de la fundición: Las fundiciones fijan las temperaturas del horno y de la cuchara de colada para que superen el liquidus de la aleación específica; para muchos aceros esto significa mantener ~1550-1600 °C en un horno de arco eléctrico o de inducción para un recalentamiento y una transferencia de cuchara adecuados. En muchos casos, el hierro fundido se funde a temperaturas más bajas.
-
Soldadura: La fusión local en la soldadura requiere un control para evitar una dilución excesiva, quemaduras o fragilización por elementos de aleación.
-
Tratamiento térmico: Aunque los tratamientos térmicos rara vez se aproximan a la fusión, las temperaturas críticas de transformación (por ejemplo, A1, A3) que determinan la microestructura se producen muy por debajo de la fusión, por lo que se utilizan diagramas de fases precisos y datos TTT/CCT.
-
Fabricación aditiva (AM metálica): Las velocidades de fusión y solidificación son muy importantes para la microestructura: los parámetros de impresión se ajustan en función de las características de fusión.
Buena práctica: trabajar siempre a partir del del material el solidus/liquidus documentado y las temperaturas del horno recomendadas por la fundición o el laminador, no sólo el número de fusión del Fe puro.
Presión y condiciones extremas
A presión ambiente, la referencia de 1538 °C es válida. A alta presión, el comportamiento de fusión cambia (importante en geofísica e investigación de materiales a alta presión). Los diagramas de fase experimentales y calculados a presiones de GPa muestran que la temperatura de fusión puede aumentar con la presión para el Fe; estos cambios están fuera de la relevancia industrial normal, pero son cruciales para el modelado del núcleo terrestre y los dispositivos de alta presión. Publicaciones especializadas y resúmenes del NIST/PDG documentan líneas de fusión dependientes de la presión.
Errores comunes y cómo evitarlos
-
Utilización del número de Fe puro para las aleaciones: conduce a ajustes erróneos del horno. Utilice siempre datos específicos del material.
-
Confundir punto de fusión con solidus/liquidus: en el caso de las aleaciones, se trata de intervalos, no de valores únicos.
-
Ignorar la atmósfera y la contaminación: Las reacciones de oxidación o de crisol alteran el comportamiento de fusión. Utilizar gases inertes o vacío si es necesario.
-
Basarse en termopares o pirómetros no calibrados: La calibración trazable a patrones es esencial para obtener temperaturas precisas.
Tablas prácticas para ingenieros
Rangos de solidus/liquidus representativos (ingeniería aprox.)
| Familia de materiales | Ejemplo de composición | Sólido aproximado (°C) | Líquido aproximado (°C) | Notas |
|---|---|---|---|---|
| Hierro puro | 0% C | 1538 (individual) | 1538 | Referencia Fe puro |
| Acero bajo en carbono | 0,05-0,25% C | 1450-1500 | 1500-1540 | Depende de la aleación |
| Acero inoxidable (austenítico) | Fe-18Cr-8Ni | ~1390-1450 | ~1450-1520 | El Ni/Cr aumenta o disminuye el comportamiento local de fusión |
| Fundición gris | 2-4% C (grafito) | ~1150 | ~1200-1250 | Características eutécticas con grafito |
Preguntas frecuentes
-
Q: ¿Cuál es el punto de fusión del hierro?
A: 1538 °C (1811 K / 2800 °F) para el hierro elemental a 1 atm. -
Q: ¿Funde el acero a la misma temperatura que el hierro puro?
A: No. El acero es una aleación y presenta una fusión gama (solidus a liquidus) que depende del contenido de carbono y aleación; muchos aceros funden algo por debajo o cerca del número de Fe puro. -
Q: ¿Por qué las fundiciones utilizan temperaturas de horno superiores a 1538 °C?
A: Los hornos mantienen recalentamiento por encima del liquidus para garantizar una buena fluidez, tiempo para la desgasificación y para compensar las pérdidas de calor durante la transferencia. Los calentamientos típicos del acero suelen mantenerse a ~1550-1600 °C en función de la aleación y el proceso. -
Q: ¿Cómo influye la concentración de carbono en la fusión?
A: El carbono reduce los puntos de fusión mediante reacciones eutécticas; los hierros fundidos (con alto contenido en C) suelen tener temperaturas de liquidus mucho más bajas que el hierro puro. Véanse los diagramas de fases Fe-C. -
Q: ¿Pueden las impurezas elevar el punto de fusión?
A: Algunos elementos aumentan y otros disminuyen el liquidus; por ejemplo, el cromo y el wolframio suelen aumentar la resistencia a altas temperaturas y pueden incrementar el comportamiento de fusión en determinadas aleaciones, mientras que el carbono y el azufre disminuyen algunos límites de fusión. Los efectos exactos dependen de la composición. -
Q: ¿Cuál es la precisión de 1538 °C?
A: Las distintas fuentes autorizadas discrepan ligeramente; los valores experimentales pueden variar en unos pocos °C en función de la pureza y el método de medición. La dispersión típica comunicada es de ~1535-1539 °C. -
Q: ¿Cuál es el calor latente de fusión del hierro?
A: Aproximadamente 247 kJ/kgutilizado para el presupuesto energético de la fusión. -
Q: ¿Cambia el oxígeno atmosférico el comportamiento efectivo de fusión?
A: Sí, la oxidación, la formación de escorias y capas de óxido y las reacciones del crisol pueden modificar el comportamiento aparente de la fusión y deben controlarse con fundentes, gestión de escorias o atmósferas inertes. -
Q: ¿Existen referencias estándar para los puntos de fusión?
A: Sí. El NIST WebBook, el CRC Handbook, los manuales ASM y las tablas PDG/LBL se utilizan ampliamente para obtener datos termofísicos fiables. -
Q: ¿Dónde puedo encontrar el solidus/liquidus de una determinada calidad de acero industrial?
A: Consulte la hoja de datos del fabricante del acero, las referencias estándar (por ejemplo, ASM, diagramas de fase Fe-C y multicomponentes publicados) o las bases de datos termodinámicas (por ejemplo, Thermo-Calc, FactSage) para obtener datos precisos sobre los límites de fase.
Notas finales para los profesionales
-
Utilice la 1538 °C cifra sólo como referencia para el hierro puro.
-
Para el control del proceso, confíe siempre en el solidus/liquidus específico del material, las hojas de datos de la fábrica/fundición y la instrumentación calibrada.
-
Para trabajos de publicación o diseño, cite bases de datos autorizadas (NIST/CRC/ASM) e indique las condiciones (presión, atmósfera, composición) en las que se aplican las temperaturas.
Referencias autorizadas
- NIST Chemistry WebBook - Datos termoquímicos y de fase condensada del hierro (Fe)
- PubChem / NCBI - Resumen y datos físicos del hierro (elemento) (incluye referencias CRC)
- Particle Data Group / LBL - Datos atómicos y de fase del Fe (hierro) (temperaturas de fusión/ebullición)
- ASM International - Manuales de metales y capítulos sobre las propiedades de los metales puros (requiere acceso)
- Recursos y material explicativo del diagrama de fases Fe-C (resúmenes académicos/de manuales)

